Faktor-Faktor Yang Mempengaruhi Laju Reaksi
1. Konsentrasi
Secara umum konsentrasi pereaksi akan mempengaruhi laju reaksi. Pengaruh konsentrasi terhadap laju reaksi adalah khas untuk setiap reaksi. Suatu larutan dengan konsentrasi tinggi tentu mengandung partikel-partikel yang lebih rapat dibandingkan dengan konsentrasi larutan rendah. Larutan dengan konsentrasi tinggi merupakan larutan pekat dan larutan dengan konsentrasi rendah merupakan larutan encer. Pengaruh konsentrasi terhadap laju reaksi ini dapat dijelaskan dengan model teori tumbukan. Semakin tinggi konsentrasi berarti semakin banyak partikel-partikel dalam setiap satuan luas ruangan. Jumlah partikel berpengaruh terhadap tumbukan efektif yang berpengaruh terhadap laju reaksi. Hal tersebut dapat dilihat pada gambar dibawah ini.
Gambar . Tumbukan partikel konsentrasi rendah dan tinggi
2. Suhu
Setiap partikel selalu bergerak. Pergerakan suatu partikel dipengaruhi oleh energy kinetik. Suatu reaksi dapat berlangsung apabila energi kinetik partikel pereaksinya dapat melampaui energy pengaktifan. Energy pengaktifan (Ea) adalah energy kinetic minimum yang harus dimiliki oleh pereaksi untuk bisa terjadi suatu reaksi. Berdasarkan teori tumbukan, adanya tumbukan efektif dalam suatu reaksi dapat mempengaruhi energy kinetic reaksi. Apabila tumbukan efektif didalam reaksi berubah, maka akan berpengaruh juga terhadap kecepatan lajunya. Suhu atau temperatur ternyata mempengaruhi energi kinetik suatu zat.
Gambar . Grafik Pengaruh Suhu terhadap Energi Kinetik Partikel
Rumus nilai peningkatan laju reaksi :
Keterangan :
r = laju reaksi akhir
r0 = laju reaksi awal
t = waktu akhir
t0 = waktu awal
Δr = kenaikkan laju reaksi
T = suhu pada laju reaksi akhir
To = suhu pada laju reaksi awal
ΔT = kenaikkan suhu
Contoh soal:
1. Harga laju reaksi bertambah 2x jika suhu dinaikkan 100C.
Reaksi A + B → C mempunyai harga laju reaksi 2x mol/L. detik pada suhu 150C. Jika reaksi tersebut dilakukan pada suhu 750C. Tentukan perubahan laju reaksinya!
Jawaban:
r = (26) x (2x mol/L. detik)
= 128x mol/L.detik
Maka Perubahan laju reaksinya = 128x.
2. Tiap kenaikkan suhu 200C laju reaksi menjadi 2x lebih cepat dari semula, jika pada suhu 200C reaksi berlangsung selama 32 menit, tentukan waktu reaksi pada suhu 800C.
maka waktu reaksi pada suhu 800C adalah 4 menit.
3. Lua Permukaan Bidang Sentuh
Pada reaksi heterogen (wujud zat tidak sama) seperti logam zink dengan larutan asam klorida, laju reaksi selain dipengaruhi oleh konsentrasi asam klorida juga dipengaruhi oleh kondisi logam zink. Reaksi terjadi antara molekul-molekul asam klorida dalam larutan dengan atom-atom zink yang bersentuhan langsung dengan asam klorida. Pada butiran zink, atom-atom zink yang bersentuhan langsung dengan asam klorida lebih sedikit daripada serbuk zink, sebab atom-atom zink yang bersentuhan hanya atom zink yang ada di permukaan butiran. Akan tetapi bila butiran zink tersebut dipecah menjadi butiran-butiran yang lebih kecil atau menjadi serbuk, maka atom-atom zink yang semula di dalam akan berada di permukaan dan terdapat lebih banyak atom zink yang secara bersamaan bereaksi dengan larutan asam klorida.
Dengan semakin kecil ukuran suatu materi, maka mengandung arti memperluas permukaan sentuh materi tersebut. Bayangkan jika kalian mempunyai benda berbentuk kubus dengan ukuran rusuk panjang, lebar, dan tinggi sama, yaitu 1 cm. Berapa luas permukaan kubus tersebut? Secara matematika dapat dihitung bahwa luas permukaan kubus sebesar 6 kali luas sisinya. Karena kubus mempunyai 6 sisi yang sama, maka jumlah luas permukaannya adalah 6 × 1 cm × 1 cm = 6 cm2. Sekarang jika kubus tersebut dipotong sehingga menjadi 8 buah kubus yang sama besar, maka keempat kubus akan mempunyai panjang, lebar, dan tinggi masing-masing 0,5 cm. Luas permukaan untuk sebuah kubus menjadi 6 × 0,5 cm × 0,5 cm = 1,5 cm2. Jumlah luas permukaan kubus menjadi 8 × 1,5 cm2 = 12 cm2. Jadi, dengan memperkecil ukuran kubus, maka luas permukaan total menjadi semakin banyak. Hitunglah jika kubus diperkecil menjadi kubus-kubus yang lebih kecil sehingga ukuran rusuknya menjadi 1 mm.
Gambar . Jika ukuran kubus diperkecil, maka luas permukaan total semakin besar.
Jika ukuran partikel suatu benda semakin kecil, maka akan semakin banyak jumlah total permukaan benda tersebut. Dengan menggunakan teori tumbukan dapat dijelaskan bahwa luas permukaan bidang sentuh zat padat berpengaruh terhadap tumbukan antar partikel zat yang bereaksi sehingga berpengaruh terhadap laju reaksi
4. Katalis
Beberapa reaksi kimia yang berlangsung lambat dapat dipercepat dengan menambahkan suatu zat ke dalamnya, tetapi zat tersebut setelah reaksi ternyata tidak berubah. Misalnya pada pengurain kalium klorat untuk menghasilkan gas oksigen.
2KClO3(s) à 2KCl (s) + 3O2 (g)
Reaksi berlangsung pada suhu tinggi dan berjalan lambat, tetapi dengan penambahan Kristal MnO2 ke dalamnya ternyata reaksi akan dapat berlangsung dengan lebih cepat pada suhu yang lebih rendah. Setelah semua KClO3 terurai, ternyata MnO2 masih tetap ada (tidak berubah). Dalam reaksi tersebut MnO2 disebut sebagai katalis.Katalis adalah suatu zat yang dapat mempercepat laju reaksi, tanpa dirinya mengalamu perubahan yang kekal. Suatu katalis mungkin dapat terlibat dalam proses reaksi atau mengalami perubahan selama reaksi berlangsung, tetapi setelah reaksi itu selesai maka katalis akan diperoleh kembali dalam jumlah yang sama. Peran katalis berhubungan energi pengaktifan. Dapat dilihat pada grafik di bawah ini:
Gambar . Grafik tingkat energi reaksi dengan katalis
Katalis mengubah jalannya reaksi. Jalur reaksi yang ditempuh tersebut mempunyai energi aktivasi yang lebih rendah dari jalur reaksi yang ditempuh tanpa katalis. Jadi dapat dikatakan bahwa katalis berpengaruh terhadap energi aktivasi yang menyebabkan perubahan laju reaksi. Terdapat ada dua cara yang dilakukan katalis dalam mempercepat reaksi, yaitu dengan membentuk senyawa antara dan yang kedua dengan cara adsorpsi.
a. Pembentukan Senyawa antara
Umumnya reaksi berjalan lambat bila energi aktivasi suatu reaksi terlalu tinggi. Agar reaksi terlalu tinggi. Agar reaksi dapat berlangsung lebih cepat, maka dapat dilakukan dengan cara menurunkan energi aktivasi. Untuk menurunkan energi aktivasi dapat dilakukan dengan mencari senyawa antara (keadaan transisi) lain yang berenergi lebih rendah. Fungsi katalis dalam hal ini mengubah jalannya reaksi sehingga diperoleh senyawa antara. Katalis homogen (katalis mempunyai fase sama dengan zat pereaksi yang dikatalis) bekerja dengan cara ini.
Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC (1)
B + AC → AB + C (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi,
A + B + C → AB + C
b. Adsorpsi
Proses katalisasi dengan cara adsorpsi umumnya dilakukan oleh katalis heterogen, yaitu katalis yang fasenya tidak sama dengan fase zat yang dikatalis (khususnya reaksi gas dengan katalis padat). Pada proses ini, molekul-molekul pereaksi akan teradsorpsi pada permukaan katalis, dengan terserapnya pereaksi dipermukaan katalis mengakibatkan zat-zat pereaksi terkonsentrasi dipermukaan katalis dan akan mempercepat laju reaksi. Kemungkinan yang lain, karena pereaksi-pereaksi teradsorpsi di permukaan katalis akan dapat menimbulkan gaya tarik antar molekul yang bereaksi, dan ini menyebabkan molekul-molekul tersebut menjadi reaktif.
Agar katalis tersebut berlangsung efektif, katalis tidak boleh mengadsorpsi zat hasil reaksi, dan dengan demikian permukaan logam akan segera ditempati oleh molekul baru. Bila zat pereaksi atau pengotor teradsorpsi dengan kuat oleh katalis maka akan menyebabkan permukaan katalis tidak aktif. Dalam keadaan tersebut, katalis dikatakan telah teracuni, dan ini akan menghambat reaksi. Contoh katalis adsorpsi adalah nikel pada pembuatan margarine, untuk mengkatalis reaksi antara gas hidrogen dengan lemak atau minyak menjadi margarine. Pada industri asam sulfat digunakan katalis V2O5 untuk mempercepat reaksi antara gas SO2 dan O2 menjadi SO3.






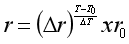










Tidak ada komentar: